La malattia di Lyme è tornata sotto i riflettori dopo il recente annuncio di Justin Timberlake, che ha rivelato di aver contratto questa infezione, spesso sottovalutata, durante il suo tour mondiale “Forget Tomorrow”. Il cantante ha descritto come dolore neuropatico, nausea e stanchezza gli abbiano reso difficile esibirsi, testimoniando l’impatto debilitante che questa infezione può avere sulla qualità di vita.
Causata dal batterio spirochete Borrelia burgdorferi, se non riconosciuta tempestivamente, la malattia di Lyme può progredire attraverso diverse fasi, interessando potenzialmente la pelle, il sistema nervoso, il cuore e le articolazioni.
- Che cos’è la Malattia di Lyme?
- Gli agenti patogeni responsabili
- Patogenesi e classificazione clinica
- Artrite di Lyme
- Artrite di Lyme Post-Infettiva: la complicazione cronica
- Encefalomielite Cronica
- Polineuropatia Sensitiva Distale
- Acrodermatite Cronica Atrofica (ACA)
- Approccio diagnostico integrato della Malattia di Lyme
- Strategie Terapeutiche della Malattia di Lyme
- Gestione delle complicanze della Malattia di Lyme
- Prevenzione della Malattia di Lyme e controllo dei vettori
- Prognosi e Follow-up
- Conclusioni
- Bibliografia
Che cos’è la Malattia di Lyme?
La malattia di Lyme rappresenta la più comune patologia trasmessa dalle zecche. È la più diffusa negli Stati Uniti e una delle più diagnosticate a livello mondiale.
Il nome deriva dalla cittadina di Lyme, nel Connecticut, dove nel 1975 furono identificati i primi casi di questa particolare forma di artrite.
Gli agenti patogeni responsabili
La malattia di Lyme, scientificamente denominata borreliosi di Lyme, è causata da spirochete del genere Borrelia, microrganismi gram-negativi caratterizzati da una particolare morfologia elicoidale che conferisce loro elevata motilità tissutale.
Mentre negli Stati Uniti la malattia è causata principalmente da Borrelia burgdorferi (e raramente da Borrelia mayonii), invece in Europa e Asia il panorama eziologico è più variegato, includendo anche Borrelia afzelii e Borrelia garinii. Ogni specie presenta caratteristiche distintive:
- B. burgdorferi: particolare affinità per le articolazioni
- B. garinii: predilezione per il tessuto nervoso
- B. afzelii: maggiore tropismo per la pelle
Il vettore di trasmissione è costituito da zecche dure del genere Ixodes: Ixodes scapularis (zecca del cervo) nel Nord America e Ixodes ricinus (zecca comune del bosco) in Europa.
Questi artropodi ematofagi completano il loro ciclo vitale in tre stadi (larva, ninfa, adulto) attraverso ospiti vertebrati di dimensioni crescenti, dai piccoli roditori agli ungulati selvatici, che fungono da serbatoio naturale dell’infezione.
Un aspetto cruciale per la prevenzione riguarda la dinamica di trasmissione. Infatti, le spirochete risiedono nell’intestino medio della zecca e migrano verso le ghiandole salivari solo dopo l’inizio del pasto ematico: questo processo richiede generalmente 36-48 ore.
Questo significa che la rimozione tempestiva del parassita è estremamente efficace nel prevenire l’infezione. La probabilità di trasmissione aumenta proporzionalmente alla durata dell’attacco, raggiungendo il 20-25% dopo 72 ore di ancoraggio.
Pubblicità
Patogenesi e classificazione clinica
La progressione della malattia di Lyme segue un pattern temporale caratteristico che riflette la disseminazione ematogena e linfatica delle spirochete dall’inoculo primario verso i tessuti bersaglio. La classificazione clinica tradizionale distingue tre stadi evolutivi, ciascuno con manifestazioni specifiche e implicazioni terapeutiche differenti.
Stadio I: Malattia Localizzata Precoce (3-30 giorni)
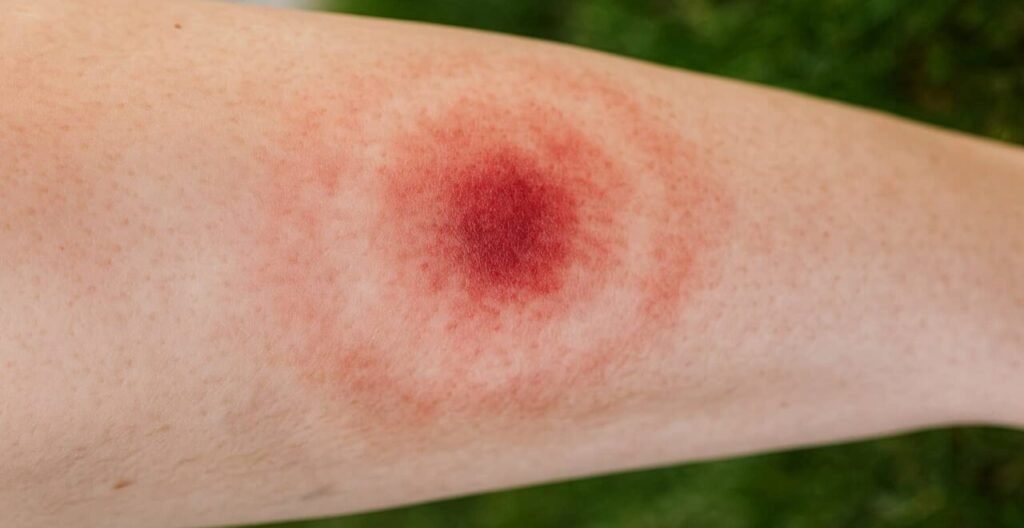
La manifestazione patognomonica di questo stadio è l’eritema migrante, presente nel 70-80% dei casi. Questa lesione cutanea inizia come una macula eritematosa nel sito di inoculo, espandendosi centrifugamente con una velocità di 2-3 cm al giorno fino al raggiungimento di diametri di 15-20 cm. La classica morfologia “a occhio di bue”, caratterizzata da un alone eritematoso periferico e un centro relativamente risparmiato, si osserva in circa la metà dei pazienti e rappresenta l’espressione della migrazione batterica attraverso i piani cutanei.
Parallelamente alle manifestazioni locali, si sviluppano sintomi sistemici aspecifici che mimano una sindrome similinfluenzale: febbre intermittente (38-39°C), cefalea, mialgie diffuse, artralgie migranti e linfoadenopatia regionale. Questi sintomi riflettono l’attivazione della risposta immunitaria innata e la liberazione di mediatori infiammatori sistemici.
Stadio II: Malattia Disseminata Precoce (settimane-mesi)
In assenza di trattamento antibiotico, le spirochete disseminano per via ematogena raggiungendo i tessuti ad alta vascolarizzazione. Le manifestazioni neurologiche rappresentano le complicanze più frequenti di questo stadio, interessando il 10-15% dei pazienti non trattati.
La paralisi del nervo facciale costituisce la manifestazione neurologica più comune (60% delle neuroborreliosi), presentandosi tipicamente come paralisi periferica unilaterale a rapida insorgenza. La bilateralità, sebbene rara (5% dei casi), è virtualmente patognomonica della malattia di Lyme. Altri quadri neurologici includono la meningite linfocitaria(pleocitosi con predominanza mononucleare, iperproteinorrachia e glucorrachia normale) e la radicolonevrite, caratterizzata da dolore radiculare intenso seguito da deficit motori e sensitivi nel territorio di distribuzione.
Il coinvolgimento cardiaco si manifesta nel 5-10% dei pazienti attraverso blocchi della conduzione atrioventricolare di grado variabile, miopericardite e, più raramente, cardiomiopatia dilatativa. I blocchi AV di alto grado possono causare sincope e richiedere pacing temporaneo.
Stadio III: Malattia Tardiva (mesi-anni)
L’evoluzione verso la cronicizzazione interessa principalmente:
- l’apparato muscolo-scheletrico, con la tipica Artrite di Lyme: è la manifestazione tardiva più frequente, comparendo nel 60% dei pazienti non trattati dopo 6 mesi-2 anni dalla infezione primaria
- l’apparato nervoso, con l’Encefalomielite Cronica, una infiammazione simultanea del cervello e del midollo spinale, e la Polineuropatia Sensitiva Distale, con danno sensitivo dei nervi periferici
- i tessuti cutanei, manifestazione tipicamente europea della malattia di Lyme, con l’acrodermatite cronica atrofica (ACA)
Nei prossimi paragrafi vedremo nel dettaglio queste manifestazioni tardive della malattia di Lyme.
Artrite di Lyme
L’artrite di Lyme rappresenta la manifestazione tardiva più frequente, sviluppandosi nel 60% dei pazienti non trattati dopo 6-24 mesi dall’infezione primaria.
Caratteristiche specifiche nell’artrite di Lyme
Il pattern artritico è tipicamente oligoarticolare asimmetrico, cioè:
- Oligoarticolare perchè sono coinvolte poche articolazioni, in genere da 1 a 3 grandi articolazioni ad episodio, a differenza della poliartrite, dove le articolazioni colpite sono tante, e della monoartrite, dove ad essere colpita è una sola articolazione
- Asimmetrico perchè le articolazioni colpite non sono speculari tra i due lati del corpo: ad esempio: può essere interessato il ginocchio destro ma non il sinistro, o la caviglia sinistra ma non la destra. Questo si contrappone all’artrite simmetrica tipica dell’artrite reumatoide, dove le stesse articolazioni sono colpite bilateralmente
Inoltre, altre caratteristiche tipiche dell’artite di Lyme sono:
- Predilezione per le grandi articolazioni degli arti inferiori: il ginocchio risulta coinvolto nell’80% dei casi, presentando episodi ricorrenti di versamento articolare, tumefazione e limitazione funzionale. Possono essere colpite anche articolazioni più piccole, come caviglie e gomiti.
- Episodi ricorrenti: periodi di infiammazione acuta alternati a remissioni spontanee
- Gonfiore marcato: spesso con versamento articolare abbondante
- Dolore variabile: può essere meno intenso rispetto al grado di gonfiore
- Migrazione: l’infiammazione può “saltare” da un’articolazione all’altra negli episodi successivi
- Liquido sinoviale: all’analisi, rivela un quadro infiammatorio con leucocitosi (10.000-50.000 cellule/μL) a predominanza neutrofila.
Questo pattern è diagnosticamente significativo perché aiuta a distinguere l’artrite di Lyme da altre forme di artrite infiammatoria, contribuendo all’orientamento diagnostico insieme agli altri elementi clinici e sierologici.
La risoluzione spontanea
Nel corso del tempo, generalmente nell’arco di 1-5 anni, nella maggior parte dei casi i sintomi tendono a diminuire anche senza intervento. La risoluzione spontanea è dovuta all’azione del sistema immunitario dell’ospite, che riesce gradualmente a eliminare i batteri e a controllare l’infiammazione, ripulendo via via le articolazioni e spegnendo l’infiammazione.
Artrite di Lyme Post-Infettiva: la complicazione cronica
In una piccola percentuale di pazienti con artrite di Lyme, circa il 10%, può svilupparsi un’artrite infiammatoria cronica simile all’artrite reumatoide, che persiste nonostante l’eliminazione dell’infezione batterica. Questa complicanza della malattia di Lyme è definita artrite di Lyme post-infettiva.
Clinicamente, è la transizione da una malattia infettiva a una condizione autoimmune.
Fisiopatologia dell’artrite di Lyme post-infettiva
Esistono varie teorie che provano a spiegare la fisiopatologia di questa complicazione.
La teoria del mimetismo molecolare suggerisce che alcune proteine batteriche di Borrelia presentano somiglianze strutturali con proteine delle articolazioni umane, causando una reazione crociata degli anticorpi che, inizialmente diretti contro il batterio, finiscono per attaccare i tessuti articolari dell’ospite, determinando una perdita della tolleranza immunologica.
La teoria dei detriti antigenici, d’altra parte, propone che frammenti batterici persistano nelle articolazioni anche dopo l’eliminazione dei batteri vitali, mantenendo una stimolazione cronica del sistema immunitario e perpetuando l’infiammazione.
Infine, la predisposizione genetica gioca un ruolo cruciale: pazienti portatori di specifici alleli HLA (particolarmente HLA-DRB10401 e DRB10101) mostrano maggiore suscettibilità allo sviluppo di risposte autoimmuni e presentano una clearance meno efficace dei complessi immuni.
Caratteristiche cliniche distintive dell’artrite di Lyme post-infettiva
La somiglianza con l’artrite reumatoide
Dal punto di vista clinico, l’artrite di Lyme post-infettiva presenta notevoli somiglianze con l’artrite reumatoide, manifestandosi con una sinovite cronica caratterizzata da iperplasia sinoviale marcata, con un denso infiltrato linfoplasmacellulare, neoangiogenesi e depositi di fibrina che testimoniano il processo infiammatorio cronico.
Similmente all’artrite reumatoide, è presente rigidità mattutina prolungata superiore a un’ora, possibile coinvolgimento simmetrico delle articolazioni (diversamente dalla fase acuta che è tipicamente asimmetrica), erosioni articolari progressive e markers infiammatori persistentemente elevati come VES e Proteina C Reattiva.
Come distinguere l’artrite di Lyme post-infettiva dall’artrite reumatoide?
L’artrite di Lyme post-infettivasi distingue tuttavia dall’artrite reumatoide per alcune caratteristiche specifiche: il fattore reumatoide è generalmente negativo, così come gli anticorpi anti-CCP, mantiene una predilezione per le grandi articolazioni piuttosto che per le piccole articolazioni di mani e piedi, e non presenta i noduli reumatoidi tipici dell’artrite reumatoide.
Un elemento fondamentale per la diagnosi è l’assenza di infezione attiva, confermata da colture batteriche negative, PCR (reazione a catena della polimerasi, una tecnica di amplificazione del DNA che permette di rilevare anche minime quantità di materiale genetico batterico) per Borrelia negativa e assenza di spirocheti vitali nei tessuti, dimostrando che l’infiammazione persiste indipendentemente dalla presenza del patogeno originario.
Le implicazioni terapeutiche delle due forme di artrite
Per l’artrite di Lyme tipica:
- Osservazione clinica: Possibile approccio wait-and-see nei casi lievi
- Trattamento antibiotico: Raccomandato per accelerare la risoluzione
- Supporto sintomatico: FANS, fisioterapia
Per l’artrite post-infettiva:
- Antibiotici aggiuntivi: Generalmente sono inefficaci
- Terapie immunosoppressive: DMARDs (Disease-Modifying Antirheumatic Drugs), come quelle utilizzate nell’artrite reumatoide. Si tratta, cioè, di farmaci che modificano il decorso delle malattie reumatiche infiammatorie, come il Metotrexate, la sulfasalazina, l’idrossiclorochina (DMARDs convenzionali), oppure l’anti-TNF (etanercept, adalimumab), l’anti-IL6, l’anti-CD20, ecc.(DMARDs biologici)
- Corticosteroidi intra-articolari: Per mantenere un controllo locale dell’infiammazione
- Sinoviectomia: Nei casi refrattari agli altri trattamenti
Questa distinzione tra i due tipi di artrite è fondamentale perché determina approcci terapeutici completamente diversi: mentre l’artrite di Lyme attiva risponde agli antibiotici, la forma post-infettiva richiede terapie immunomodulatorie simili a quelle utilizzate per l’artrite reumatoide, rappresentando una vera e propria condizione autoimmune scatenata dall’infezione iniziale.
Encefalomielite Cronica
Le manifestazioni neurologiche tardive rappresentano alcune delle complicazioni più complesse e debilitanti della malattia di Lyme non trattata.
L’encefalomielite rappresenta un’infiammazione simultanea del cervello e del midollo spinale che, nella forma cronica associata alla malattia di Lyme, coinvolge un processo fisiopatologico complesso.
Fisiopatologia dell’Encefalomielite Cronica
L’infiammazione persistente interessa sia la sostanza grigia che quella bianca del sistema nervoso centrale, determinando una compromissione della barriera emato-encefalica che normalmente protegge il tessuto cerebrale. Questa risposta immunitaria cronica può provocare un danno tissutale progressivo, con conseguenze neurologiche significative.
Manifestazioni cliniche principali dell’Encefalomielite Cronica
Deficit cognitivi
Le manifestazioni cliniche principali si concentrano sui deficit cognitivi, che includono difficoltà di concentrazione e attenzione sostenuta, rallentamento nel processamento delle informazioni, problemi nelle funzioni esecutive come pianificazione e organizzazione, e una ridotta capacità di gestire più compiti simultaneamente.
Disturbi della memoria
I disturbi della memoria sono altrettanto rilevanti, manifestandosi con perdita di memoria a breve termine, difficoltà nell’apprendimento di nuove informazioni, problemi nel recupero delle informazioni già acquisite (il cosiddetto fenomeno “sulla punta della lingua”, “tip-of-the-tongue phenomenon”) e possibili lacune nella memoria episodica.
Altri sintomi associati
Oltre a questi aspetti neurocognitivi, i pazienti possono presentare cambiamenti significativi della personalità e dell’umore, irritabilità e labilità emotiva, disturbi del sonno che compromettono ulteriormente le funzioni cognitive, e cefalea persistente che rappresenta spesso il sintomo più debilitante dal punto di vista soggettivo.
Polineuropatia Sensitiva Distale
Caratteristiche anatomiche della Polineuropatia Sensitiva Distale
La polineuropatia sensitiva distale rappresenta un danno diffuso ai nervi sensitivi periferici con caratteristiche anatomiche specifiche: vengono coinvolte principalmente le fibre nervose sensoriali delle parti più lontane dal centro del corpo (distali, appunto), come mani e piedi, con una distribuzione tipicamente simmetrica e bilaterale che viene descritta come “a calza e guanto” per la sua caratteristica localizzazione.
Fisiopatologia
Dal punto di vista fisiopatologico, si verifica una degenerazione assonale che interessa preferenzialmente le fibre nervose più lunghe, accompagnata da un processo infiammatorio che danneggia sia la mielina che gli assoni stessi, compromettendo il normale trasporto assonale necessario per il funzionamento nervoso.
Manifestazioni cliniche
Sintomi sensitivi
Le manifestazioni cliniche si caratterizzano per sintomi sensitivi distinti: parestesie come formicolii e intorpidimento, disestesie che causano sensazioni anomale e spiacevoli, dolore neuropatico di tipo urente o lancinante, e perdita progressiva della sensibilità vibratoria e propriocettiva.
Distribuzione tipica
La distribuzione dei sintomi segue un pattern caratteristico “lunghezza-dipendente” , iniziando dalle dita dei piedi per risalire gradualmente verso l’alto, con successivo coinvolgimento delle mani.
Conseguenze funzionali
Le conseguenze funzionali sono significative e includono difficoltà nella deambulazione che si accentuano particolarmente al buio quando viene meno il compenso visivo, perdita di equilibrio e coordinazione, compromissione della capacità di manipolazione fine degli oggetti, e un aumentato rischio di cadute dovuto alla perdita della sensibilità propriocettiva che normalmente contribuisce al mantenimento della stabilità posturale.
Acrodermatite Cronica Atrofica (ACA)
L’acrodermatite cronica atrofica (ACA) è una manifestazione tardiva della malattia di Lyme tipica dell’area europea e legata soprattutto all’infezione da Borrelia afzelii. Si tratta di una dermatosi infiammatoria a lenta evoluzione, che può manifestarsi diversi anni dopo l’infezione primaria, spesso in soggetti che non hanno ricevuto un trattamento antibiotico adeguato o tempestivo.
Eziologia e patogenesi dell’Acrodermatite Cronica Atrofica
Il ceppo B. afzelii mostra un particolare tropismo per il tessuto cutaneo, ed è responsabile di una risposta infiammatoria persistente a livello dermico. Nel tempo, questa infiammazione cronica determina alterazioni vascolari, attivazione di enzimi degradanti il collagene (metalloproteinasi) e perdita progressiva del tessuto connettivo dermico e sottocutaneo.
Decorso clinico e presentazione
L’acrodermatite cronica atrofica si sviluppa in due fasi distinte.
- Fase infiammatoria iniziale: caratterizzata da lesioni eritematose di colorito violaceo o bluastro, edema locale, sensazione di calore, bruciore o dolore.
- Fase atrofica tardiva: col tempo, dopo mesi o anni dall’esordio, queste alterazioni cutanee progrediscono verso una fase atrofica, nella quale la cute si assottiglia in modo marcato, perde elasticità e diventa traslucida, con un aspetto simile alla “carta velina”. Le strutture sottostanti possono diventare visibili, e la cute appare fragile e vulnerabile.
Localizzazione e popolazione colpita
Le lesioni dell’acrodermatite cronica atrofica tendono a localizzarsi in modo asimmetrico, preferendo le superfici estensorie degli arti, in particolare il dorso delle mani e dei piedi, avambracci, gomiti, gambe e ginocchia. La condizione è più frequente nel sesso femminile, soprattutto oltre i 50 anni, e tende a evolvere molto lentamente, spesso nell’arco di anni.
Manifestazioni associate all’Acrodermatite Cronica Atrofica
Oltre alle alterazioni cutanee, possono formarsi:
- Noduli fibrosi nelle zone atrofiche, soprattutto in corrispondenza delle prominenze ossee (es. olecrano, rotula), di consistenza duro-elastica.
- Alterazioni ungueali, teleangectasie superficiali e modificazioni della pigmentazione cutanea, segni che contribuiscono alla diagnosi.
Diagnosi dell’Acrodermatite Cronica Atrofica
La diagnosi è clinica e si basa sull’osservazione dell’aspetto morfologico e della distribuzione caratteristica delle lesioni, sulla documentazione di una lenta progressione temporale del quadro cutaneo e sulla presenza di una storia di esposizione in zone endemiche europee.
Diagnosi differenziale
È fondamentale distinguere l’ACA da altre condizioni che causano atrofia cutanea o sclerosi localizzata, come la morfea, il lichen sclerosus, o l’insufficienza venosa cronica. Dal punto di vista clinico, rappresenta un segno indicativo di un’infezione da Borrelia afzelii non adeguatamente trattata.
Trattamento e prognosi dell’Acrodermatite Cronica Atrofica
Nella fase infiammatoria, il trattamento con antibiotici (es. doxiciclina) può dare buoni risultati, mentre nella fase atrofica i miglioramenti sono limitati, e i danni tissutali risultano spesso irreversibili.
Per questo motivo, pur trattandosi di una condizione generalmente benigna e confinata alla cute, l’ACA può causare un impatto estetico e funzionale significativo. Se diagnosticata e trattata nelle fasi iniziali, è possibile rallentarne la progressione e ottenere un parziale miglioramento del quadro clinico, limitando le conseguenze estetiche e funzionali a lungo termine.
Pubblicità
Approccio diagnostico integrato della Malattia di Lyme
La diagnosi della malattia di Lyme richiede un approccio integrato che combini elementi epidemiologici, clinici e laboratoristici. L’assenza di test diagnostici diretti rapidi e affidabili rende cruciale il riconoscimento dei pattern clinici caratteristici e l’interpretazione critica dei risultati sierologici.
Diagnosi clinica
La diagnosi clinica assume valore determinante in presenza di eritema migrante in pazienti con anamnesi di esposizione a zecche in aree endemiche. La morfologia caratteristica della lesione, la sua evoluzione temporale e il contesto epidemiologico consentono una diagnosi di certezza che non richiede conferma sierologica.
Per le manifestazioni extracutanee, la diagnosi si basa sul riconoscimento di pattern sindromici specifici: paralisi facciale unilaterale o bilaterale in soggetti giovani durante i mesi estivi, artrite oligoarticolare asimmetrica delle grandi articolazioni, blocchi AV in pazienti senza cardiopatia strutturale nota.
Diagnostica sierologica
Il test sierologico a due fasi rappresenta l’approccio standard per la conferma diagnostica. La prima fase prevede uno screening mediante ELISA o immunofluorescenza indiretta per la ricerca di anticorpi totali anti-Borrelia. I campioni positivi o borderline vengono quindi sottoposti a Western blot per la conferma e la caratterizzazione della risposta anticorpale.
La diagnosi sierologica presenta tuttavia alcuni limiti: nelle prime 2-4 settimane possono infatti esserci falsi negativi a causa di una sensibilità inferiore al 50%; inoltre la persistenza degli anticorpi IgG dopo trattamento efficace e la possibilità di reazioni crociate con altre spirochetosi (sifilide, febbre ricorrente), malattie autoimmuni (artrite reumatoide, lupus eritematoso sistemico) e infezioni virali (EBV, CMV) possono determinare falsi positivi.
Test diagnostici diretti
La reazione a catena della polimerasi (PCR) rappresenta il test diretto di elezione per la ricerca del DNA batterico in campioni biologici sterili.
L’applicazione più consolidata riguarda l’analisi del liquido sinoviale nell’artrite di Lyme, dove la sensibilità raggiunge il 70-85%. Nel liquor, la PCR mostra sensibilità inferiore (30-50%) ma elevata specificità, risultando utile nei casi di neuroborreliosi con sierologia dubbia.
Strategie Terapeutiche della Malattia di Lyme
Il trattamento della malattia di Lyme si basa su protocolli antibiotici specifici modulati in base allo stadio clinico, alle manifestazioni sistemiche e alle caratteristiche del paziente. L’efficacia terapeutica è strettamente correlata alla precocità dell’intervento, con tassi di guarigione superiori al 95% negli stadi precoci.
Profilassi Post-Esposizione
La profilassi antibiotica è raccomandata in presenza di specifici criteri epidemiologici e clinici: zecca Ixodes identificata, durata dell’attacco ≥36 ore, rimozione entro 72 ore, area endemica con incidenza >20%. Il regime standard prevede doxiciclina 200 mg in dose singola negli adulti (4.4 mg/kg nei bambini >8 anni, massimo 200 mg).
L’efficacia profilattica della doxiciclina è stata dimostrata in studi controllati randomizzati, con una riduzione del rischio di infezione dell’87% rispetto al placebo. La finestra terapeutica ottimale si estende fino a 72 ore dalla rimozione della zecca.
Trattamento nei diversi stadi clinici
Stadio I (Eritema Migrante).
Il trattamento di prima linea prevede doxiciclina 100 mg due volte al giorno per 10-14 giorni, che assicura un’eccellente penetrazione tissutale e attività antinfiammatoria aggiuntiva. Le alternative includono amoxicillina 500 mg tre volte al giorno (preferita in gravidanza e pediatria <8 anni) e cefuroxima axetil 500 mg due volte al giorno.
Stadio II (Manifestazioni Neurologiche).
La neuroborreliosi richiede antibiotici con elevata penetrazione liquorale. Ceftriaxone 2 g EV die per 14-21 giorni rappresenta il trattamento di elezione, con tassi di risposta del 85-95%. La doxiciclina orale 200 mg due volte al giorno può essere considerata nelle forme lievi (paralisi facciale isolata) con il vantaggio della somministrazione ambulatoriale.
Coinvolgimento Cardiaco
La cardite di Lyme richiede inizialmente terapia endovenosa con ceftriaxone 2 g die, seguita da completamento orale dopo stabilizzazione clinica. I pazienti con blocchi AV di alto grado necessitano di monitoraggio cardiaco continuo e possibile pacing temporaneo.
Stadio III (Artrite Tardiva)
L’artrite di Lyme risponde generalmente alla terapia orale prolungata: doxiciclina 100 mg due volte al giorno o amoxicillina 500 mg tre volte al giorno per 28 giorni. La mancata risposta dopo due cicli antibiotici suggerisce artrite post-infettiva autoimmune, che richiede approccio reumatologico specifico.
Popolazioni Speciali
Età Pediatrica: Nei bambini con una età inferiore agli 8 anni si evitano le tetracicline per il rischio di colorazione dentaria, preferendo amoxicillina 50 mg/kg/die divisa in tre dosi (massimo 500 mg/dose).
Gravidanza: Il trattamento segue gli stessi principi della popolazione generale, evitando la doxiciclina per il rischio teratogeno. L’ Amoxicillina rappresenta la prima scelta orale, mentre il ceftriaxone è preferito nelle forme gravi.
Gestione delle complicanze della Malattia di Lyme
Sindrome Post-Trattamento (PTLDS)
La sindrome post-trattamento della malattia di Lyme (PTLDS) si manifesta nel 10-20% dei pazienti dopo terapia antibiotica appropriata, caratterizzandosi per la persistenza di sintomi aspecifici: astenia, artralgie, mialgie, deficit cognitivi e disturbi del sonno.
L’eziologia della PTLDS rimane controversa, con ipotesi che spaziano dalla persistenza di antigeni batterici non vitali all’attivazione di meccanismi autoimmuni post-infettivi. Studi controllati randomizzati hanno dimostrato l’inefficacia di cicli antibiotici prolungati, che comportano inoltre significativi rischi di tossicità senza benefici clinici documentati.
La gestione ottimale prevede un approccio multidisciplinare con supporto sintomatico, riabilitazione funzionale graduale e supporto psicologico quando indicato. È essenziale escludere diagnosi alternative (fibromialgia, sindrome da fatica cronica, patologie autoimmuni).
Coinfezioni
La co-trasmissione di altri patogeni da parte delle stesse zecche rappresenta una complicanza emergente che può modificare il quadro clinico e la risposta terapeutica. Babesia microti e Anaplasma phagocytophilum sono i copatogeni più frequenti, presenti nel 10-40% delle zecche infette secondo le aree geografiche.
La babesiosi si manifesta con febbre elevata, anemia emolitica e trombocitopenia, richiedendo terapia specifica con atovaquone-azitromicina o clindamicina-chinino. L’anaplasmosi presenta febbre, leucopenia e transaminasi elevate, rispondendo a doxiciclina.
Pubblicità
Prevenzione della Malattia di Lyme e controllo dei vettori

La prevenzione primaria della malattia di Lyme si basa su strategie integrate di protezione individuale e controllo ambientale. L’educazione sanitaria assume ruolo centrale nel promuovere comportamenti protettivi durante le attività outdoor.
Misure di Protezione Individuale
L’utilizzo di repellenti cutanei contenenti DEET (20-30%) o picaridina fornisce protezione efficace per 4-8 ore. L’applicazione di permetrina sui tessuti (0.5%) offre protezione residua attraverso multipli lavaggi.
L’abbigliamento protettivo include indumenti coprenti di colore chiaro, calzature chiuse e l’inserimento dei pantaloni nelle calze per creare una barriera meccanica. Il controllo corporeo sistematico dopo l’esposizione, con particolare attenzione alle aree calde e umide (cuoio capelluto, ascelle, inguine), consente la rimozione tempestiva dei parassiti.
Rimozione corretta delle zecche
La tecnica di rimozione influenza significativamente il rischio di trasmissione. Si utilizza una pinzetta a punta sottile afferrando la zecca il più vicino possibile alla superficie cutanea, esercitando una trazione costante e perpendicolare senza movimenti rotatori. Vanno evitati metodi tradizionali (olio, alcool, fiammifero) che possono stimolare il rigurgito del contenuto gastrico della zecca.
Dopo la rimozione, l’area va disinfettata e monitorata per 30 giorni per l’eventuale comparsa di eritema migrante. La zecca può essere conservata in alcool per eventuale identificazione entomologica.
Prognosi e Follow-up
La prognosi della malattia di Lyme è eccellente quando il trattamento viene iniziato negli stadi precoci, con tassi di guarigione completa superiori al 95%. I fattori prognostici negativi includono la diagnosi tardiva, la presenza di coinfezioni, il coinvolgimento neurologico o cardiaco e l’età avanzata.
Il follow-up clinico è generalmente sufficiente per valutare la risposta terapeutica, non essendo raccomandata la ripetizione routinaria dei test sierologici che possono rimanere positivi per anni dopo trattamento efficace. La persistenza o recidiva di sintomi specifici può richiedere rivalutazione diagnostica per escludere fallimento terapeutico o diagnosi alternative.
Conclusioni
La malattia di Lyme rappresenta una sfida clinica multisfaccettata che richiede elevata competenza diagnostica e approccio terapeutico basato sulle evidenze.
Il successo terapeutico dipende crucialmente dalla precocità del riconoscimento clinico e dall’appropriatezza dell’intervento antibiotico, mentre la prevenzione attraverso misure di protezione individuale rimane l’arma più efficace per ridurre l’impatto epidemiologico di questa infezione emergente.
Bibliografia
Skar GL, Blum MA, Simonsen KA. Lyme Disease. [Updated 2024 Oct 1]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK431066/
Hatchette, T. F., Davis, I., & Johnston, B. L. (2014). Lyme disease: clinical diagnosis and treatment. Canada communicable disease report = Releve des maladies transmissibles au Canada, 40(11), 194–208. https://doi.org/10.14745/ccdr.v40i11a01
DeLong, A., Hsu, M., & Kotsoris, H. (2019). Estimation of cumulative number of post-treatment Lyme disease cases in the US, 2016 and 2020. BMC public health, 19(1), 352. https://doi.org/10.1186/s12889-019-6681-9
Bobe, J. R., Jutras, B. L., Horn, E. J., Embers, M. E., Bailey, A., Moritz, R. L., Zhang, Y., Soloski, M. J., Ostfeld, R. S., Marconi, R. T., Aucott, J., Ma’ayan, A., Keesing, F., Lewis, K., Ben Mamoun, C., Rebman, A. W., McClune, M. E., Breitschwerdt, E. B., Reddy, P. J., Maggi, R., … Fallon, B. A. (2021). Recent Progress in Lyme Disease and Remaining Challenges. Frontiers in medicine, 8, 666554. https://doi.org/10.3389/fmed.2021.666554
Bernard, Q., Thakur, M., Smith, A. A., Kitsou, C., Yang, X., & Pal, U. (2019). Borrelia burgdorferi protein interactions critical for microbial persistence in mammals. Cellular microbiology, 21(2), e12885. https://doi.org/10.1111/cmi.12885
Pubblicità



